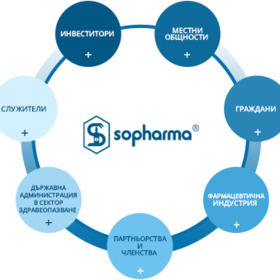
Факти и Новини
Финансови новини
1,663,016
BGN'000 Приходи 2022
139,980
BGN'000 EBITDA 2022
Информация за акциите
Българска Фондова Борса
Варшавска Фондова Борса
Корпоративни новини
28 Октомври 2021



НАШИТЕ ИСТОРИИ